| 1 |

|
ข้อ ค. |
|
ตอนที่2 จากกฎของชาร์ล จะได้ R = X , S เพิ่มขึ้นเพราะจุ่มในน้ำร้อน ในทำนองเดียวกับ Y ลดลงเพราะ จุ่มน้ำเย็น , จุ่มในน้ำเย็นปริมาตรลดลงเพราะ V แปรผันตรงกับ T เมื่อโมลและความดันคงที่ |
ใช้กฎของชาร์ล กล่าวว่า ถ้าความดันคงที่ ปริมาตรของแก๊สจะแปรผันตรงกับอุณหภูมิของแก๊สนั้น ๆ |
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|
| 2 |

|
ข้อ ค. |
|
จาก D = PM/RT ที่ STP P=1, T=273 K แล้วเทียบสัมประสิทธิ์ได้ความชันเป็นดังข้อ ค. |
ใช้ PV = nRT
PV = (g/M)RT
g/V = PM/RT
D = PM/RT |
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|
| 3 |

|
ข้อ ก. |
|
ปฏิกิริยา 1,2 มีแก๊สเกิดขึ้น และ 3. มีตะกอน CaCO3 เกิดขึ้น |
หมู่ 2 เมื่อไปจับกับ CO3^- จะตกตะกอน |
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|
| 4 |

|
ข้อ ข. |
|
ทุกๆ 1 นาที สาร A ลดลง 1 โมล สาร B ลดลง 0.5 โมล สาร D เกิดขึ้น 2 โมล สาร C คงที่ตลอดการทดลอง แต่ สาร B เป็นสารกำหนดปริมาณจึงทำให้ A เหลือ 1 โมล |
สารกำหนดปริมาณ คือ สารตั้งต้นที่จะใช้หมดก่อนเมื่อปฏิกิริยาสมบูรณ์ |
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|
| 5 |

|
ข้อ จ. |
|
เพราะการใส่ตัวเร่งทำให้ค่าพลังงานก่อกัมมันต์ลดลง |
พลังงานก่อกัมมันต์ คือ พลังงานที่น้อยที่สุดที่เกิดจากการชนของอนุภาคของสารตั้งต้น แล้วทำให้เกิดปฏิกิริยาเคมี |
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|
| 6 |

|
ข้อ ค. |
|
ข้อ 3. ผิด เพราะ ความเข้มข้นของ H2, I2, HI ไม่เท่ากัน โดยที่สมดุลค่าความเข้มข้นของ H2, I2 จะลดลง แต่ HI เพิ่มขึ้น |
|
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|
| 7 |

|
ข้อ ก. |
|
1. ถูก เมื่อปฏิกิริยานี้เป็นแบบคายความร้อน เพราะเมื่อเพิ่มอุณหภูมิสมดุลจะเลื่อนซ้าย ที่สมดุลใหม่ความเข้มข้นของ X ,Y เพิ่มขึ้น แต่ Z ลดลง |
|
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|
| 8 |
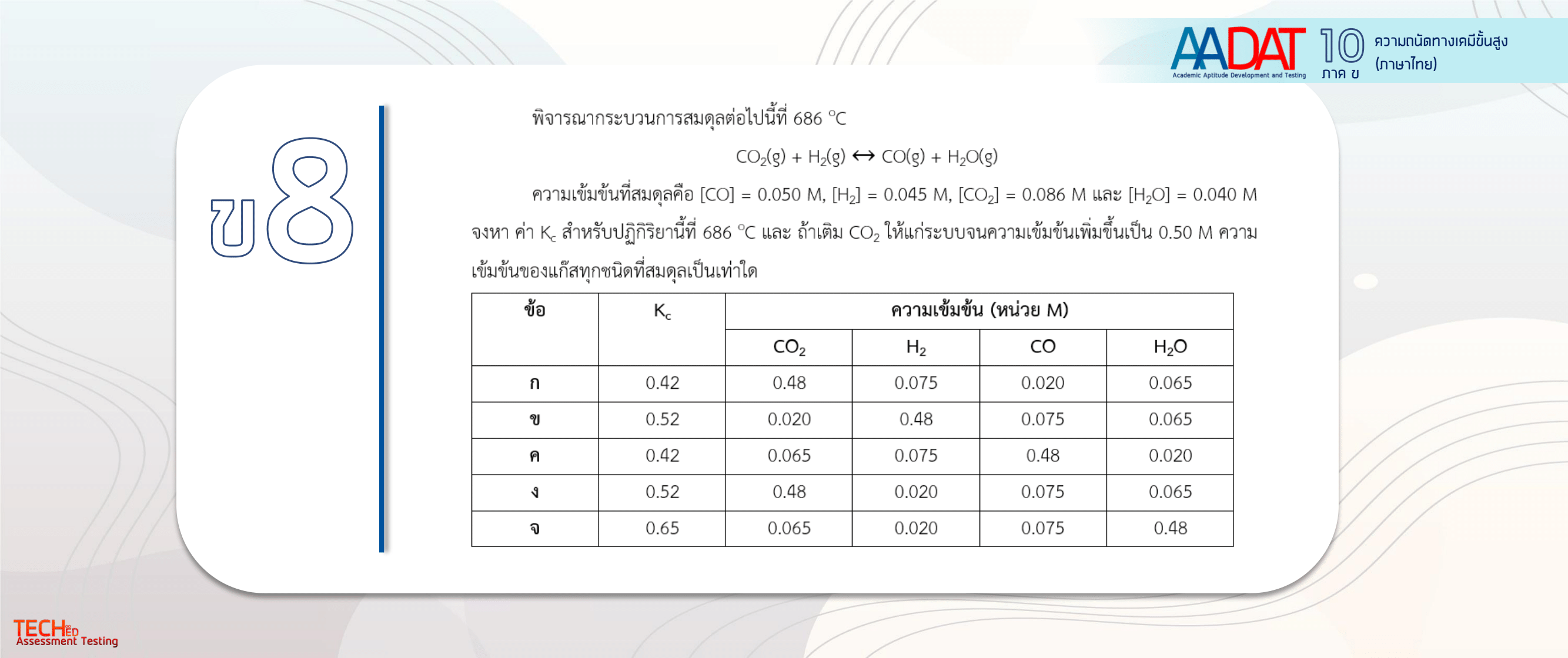
|
|
|
|
|
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|
| 9 |

|
ข้อ ข. |
|
HCO3- คู่กรดกับ H2O, OH- คู่เบสกับ CO3^2- |
ทฤษฎีกรด-เบสของเบรินสเตด-ลาวรี นิยามว่า กรด คือ สารที่ให้โปรตอน และ เบส คือ สารที่รับโปรตอน |
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|
| 10 |

|
ข้อ ข. |
|
|
ความแรงของกรดและเบส คือ ความสามารถในการแตกตัวในการให้โปรตอน(กรด) และความสามารถในการรับโปรตอน(เบส) |
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|
| 11 |

|
ข้อ ง. |
|
หาความเข้มข้นของกรดไดโปรติกหน่วยโมลาร์จากปฏิกิริยา แล้วนำไปหากรัมต่อโมล |
-กรดไดโปรติกคือ H2A
-ปฏิกิริยาสะเทิน เป็นปฏิกิริยาที่กรดและเบสทำปฏิกิริยากันเกิดเป็นเกลือ |
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|
| 12 |

|
ข้อ ง. |
|
pH ของสารควรต่ำกว่า 4.2 (จากข้อ ข) ดังนั้น ง. ควรเป็นสีเหลือง |
อินดิเคเตอร์ (Indicator) คือ สารที่ใช้ทดสอบความเป็นกรด – เบส ของสารละลาย โดยส่วนใหญ่จะเป็นอินทรีย์ที่มีโครงสร้างสลับซับซ้อนมีสมบัติเป็นกรดอ่อนหรือเบสอ่อนแต่ส่วนใหญ่จะเป็นกรดอ่อน |
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|
| 13 |

|
ข้อ ข. |
|
|
|
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|
| 14 |

|
ข้อ ง. |
|
|
ตัวรีดิวซ์ คือสารที่รับหน้าที่ให้อิเล็กตรอนแก่สารอื่น(ตัวออกซิไดซ์) ตัวรีดิวซ์จึงมีเลขออกซิเดชันเพิ่มขึ้น (เกิดออกซิเดชัน หรือถูกออกซิไดซ์) |
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|
| 15 |

|
ข้อ ง. |
|
ข้อ ข. ตัวออกซิไดซ์ คือ C+, ตัวรีดิวซ์ คือ B
ข้อ ค. ตัวออกซิไดซ์ คือ D+, ตัวรีดิวซ์ คือ C
จึงเกิดได้ตามธรรมชาติ |
-ปฏิกิริยารีดอกซ์จะเกิดขึ้นจริงตามธรรมชาติ ตัวรีดิวซ์ต้องมาจากครึ่งเซลล์ที่มีค่า E0 ต่ำกว่า ส่วนตัวออกซิไดซ์ต้องมาจากครึ่งเซลล์ที่มีค่า E0 มากกว่า
-E0 เป็นค่าศักย์ไฟฟ้ามาตรฐานของปฏิกิริยารีดักชัน |
10 |
-.50
-.25
+.25
เต็ม
0
-35%
+30%
+35%
|